يتصدر الذكاء الاصطناعي العديد من الصناعات والتقنيات، مثل مساعدة التطبيقات الرقمية والروبوتات وأنظمة الأمن. ومع ذلك، فإن الذكاء الاصطناعي ساهم فى تحسين العديد من المجالات بشكل فاق التوقعات. فالمهام البسيطة، مثل التصحيح التلقائي والتسوق عبر الإنترنت وحتى حجز موعد مع الطبيب عبر الإنترنت، أصبحت الآن تتطلب تدخل الذكاء الاصطناعي. لذا، فإن السؤال البديهي الآن؛ ومع استمرار التوسع في استخدام الذكاء الاصطناعي، كيف يمكننا تسخير إمكاناته لعلاج أورام المخ بشكل أكثر فعالية؟
ومما يستحق الذكر أنه في الوقت الحالي، يمكن استخدام الذكاء الاصطناعي للكشف عن أورام المخ وتشخيصها وعلاجها. ونتج عن تطبيق إمكانات الذكاء الاصطناعى في هذة المجالات الطبيىة العديد من الفوائد: حيث أصبحت تؤدى بشكل أسرع وأرخص وأكثر كفاءة مقارنةً بالعنصر البشري.
لقد غيّر الذكاء الاصطناعي صناعة الرعاية الصحية من خلال توفير حلول مبتكرة للمشاكل الطبية المعقدة. ويتقدم الذكاء الاصطناعي الآن ليقدم تشخيصات وعلاجات متفائلة لأورام المخ، والتي تعد من أكثر أنواع السرطانات تعقيداً التي تصيب الناس اليوم. وبفضل قدرته على تحليل كميات كبيرة من البيانات بسرعة ودقة، يُحدث الذكاء الاصطناعي ثورة في تشخيص أورام المخ، مما يمكّن الأطباء من اتخاذ قرارات أكثر استنارة بشأن رعاية المرضى. دعونا نستكشف الآفاق الواعدة للذكاء الاصطناعي في تشخيص أورام المخ وعلاجها، بالإضافة إلى حدوده وآفاقه المحتملة. لذا، دعونا نتعمق في الأمر!
أولا: مجالات تطبيق الذكاء الإصطناعي في منظومة علاج أورام المخ
- البحث:
يمكن للخوارزميات التي تم إنشاؤها بواسطة الذكاء الاصطناعي تحديد كميات كبيرة من البيانات للعثورعلى العلاج الأكثر فعالية لسرطانات معينة. التقنيات التي يتم تنفيذها في الأبحاث مثل تسلسل المحتوى الجيني للخلايا، الذي يحلل الطفرات في مجموعات كبيرة من البيانات، مما يعني نتائج أسرع وأرخص.
- التشخيص:
تستخدم التقنيات المستخدمة في التصوير مثل التصوير بالرنين المغناطيسي الذكاء الاصطناعي وتكتشف التشوهات بكفاءة عالية، مما يسمح باكتشاف الأورام في وقت مبكر وبصورة أسهل.حيث يمكن لخوارزميات الذكاء الاصطناعي اكتشاف أصغر التشوهات في هذه الصور التي قد لا تكون مرئية للعين البشرية. يمكن للأطباء تحليل آلاف الصور الطبية في غضون دقائق، مما يؤدي إلى تشخيص أسرع وأكثر دقة.
كما أنها تُمكِّن الأطباء من تحديد التغيرات الطفيفة في حالة المريض التي قد لا يلاحظها أحد بطريقة أخرى. كما أنها تقلل بشكل كبير من الأخطاء البشرية أثناء التشخيص والعلاج. فالعاملون في المجال الطبي هم بشر فقط ويمكن أن يخطئوا أحياناً في تفسير نتائج التصوير أو تفوتهم تفاصيل مهمة أثناء التشخيص. ومع ذلك، بمساعدة أدوات الذكاء الاصطناعي، من المحتمل أن تصبح مثل هذه الأخطاء أقل شيوعاً.
- التكهن المرضي:
من خلال تحليل مجموعات كبيرة من البيانات من الحالات السابقة، يمكن لهذه الأنظمة تعلم الأنماط والتنبؤ بكيفية تطور أورام معينة أو استجابتها لعلاجات معينة.
- العلاج:
يستخدم الذكاء الاصطناعي في العديد من أشكال العلاج مثل العلاج الإشعاعي. ويمكنه التفريق بين الخلايا السليمة والسرطانية مما يسمح بالتطبيق الدقيق بأقل الآثار الجانبية. وعلاوة على ذلك، من المتوقع أن يكون الذكاء الاصطناعي ضرورياً في وضع خطط علاجية مصممة خصيصاً لكل مريض بناءً على خصائصه المحددة؛ مما يعني إعطاء العلاج الأنسب لكل حالة. يمكن أن يؤدي هذا النهج إلى معدلات نجاح أعلى من خلال توفير علاجات مستهدفة بدلاً من الاعتماد على البروتوكولات العامة.
ثانيا: ما هي أورام المخ؟
يشهد مجال علم الأمراض العصبية، وهو تخصص فرعي في علم الأمراض يدرس الأمراض التي تصيب الجهاز العصبي، تغيرات كبيرة بسبب التقدم في مجال الذكاء الاصطناعي (AI).يعد سرطان الجهاز العصبي المركزي العاشر من حيث أسباب الوفاة لدى الرجال والنساء. ورم المخ ليس السبب الرئيسي للوفيات، إلا أن 40% من جميع أنواع السرطان الأخرى يمكن أن تتطور إلى سرطان المخ بسبب الغزو والانتقال الى اعضاء متفرقة في للجسم.
تؤثر أورام الجهاز العصبي المركزي، سواء كانت أورامًا أولية أو ثانوية، تأثيرًا كبيرًا على الصحة العالمية، حيث يتم الإبلاغ عن أكثر من 250,000 حالة سنويًا، مما يجعلها مصدر قلق عالمي كبير. ومن الجدير بالذكر أن الورم الأرومي الدبقي، وهو نوع سريع النمو وعدواني وخبيث من أورام المخ، يبرز باعتباره المساهم الرئيسي في المراضة والوفيات بين أورام المخ لدى البالغين، حيث يُظهر معدل بقاء على قيد الحياة بنسبة 6.9% لمدة 5 سنوات. تسلط هذه الأرقام الضوء على أوجه القصور الحالية في علاج أورام المخ.
الأورام الدبقية هي مجموعات غير متجانسة من الأمراض، مع العديد من الأنماط النسيجية والأنماط الجزيئية المختلفة التي تتراوح من الورم الأرومي الدبقي البطيء النمو إلى الورم الدبقي متعدد الأشكال العدواني. نظرًا لسوء تشخيص المرضى الذين يعانون من سرطان المخ في مراحل متقدمة، فإن التصنيف الدقيق أمر بالغ الأهمية للعلاج والتشخيص.
تشمل الاختبارات الشائعة المستخدمة لتشخيص الأورام وتقدير الدرجة الفحص العصبي، التصوير، الخزعات، وعلامات البيولوجية. تعتبر الخزعات هي المعيار الذهبي، لكنها تتسم بالتوغل والمخاطر. تُستخدم تقنيات مثل التصوير المقطعي المحوسب مع الصبغة أو التصوير بالرنين المغناطيسي لتشخيص أورام المخ. نظرًا لأنها غير غازية ومتاحة، تم بذل العديد من الجهود لزيادة المعلومات المستخلصة من تصوير المخ.
على الرغم من العديد من التجارب السريرية وعقود من الأبحاث، لا تزال هناك أورام دماغية غير قابلة للشفاء مع توقعات قاتمة للتشخيص، مثل الورم الدبقي المنتشر في الخط الأوسط (DMG) الذي يظهر لدى الأطفال والورم الأرومي الدبقي لدى البالغين. تسلط هذه الحاجة الملحة الضوء على الحاجة إلى نهج علاجي مخصص، والذي قد يوفر أعلى احتمالية للشفاء مع تقليل حدوث السمية المحتملة للمريض. ومع ذلك، يواجه تطوير الاستراتيجيات الشخصية عقبات بسبب صعوبة تعميم المقاربات المستمدة من البيانات التي تنشأ في مؤسسة منفردة أو اتحاد محدود من المؤسسات، ومحدودية الوصول إلى التقنيات المتقدمة والتجارب السريرية، التي تتركز في المقام الأول في المراكز المتخصصة. ويصبح هذا الأمر مصدر قلق بالغ الأهمية، خاصة عند التفكير في التداعيات الأخلاقية المرتبطة بتطوير مقاربات تستند إلى بيانات تفتقر إلى التمثيل عبر التركيبة السكانية المتنوعة. ومن المثير للقلق أن الأفراد المصابين بالورم الأرومي الدبقي من خلفيات اجتماعية واقتصادية منخفضة هم أقل عرضة للخضوع للاختبار. قد يؤدي غياب اختبار MGMT إلى تحريف التنبؤات والمساهمة في التشخيص في مرحلة متأخرة مع أورام أكبر وأكثر صعوبة. وعلاوة على ذلك، فإن هذه الفئة السكانية أقل حظًا في كثير من الأحيان مع مجموعة من طرائق العلاج المتنوعة، مما يؤدي إلى انخفاض معدلات البقاء على قيد الحياة.
ومع ذلك، فإن هذه الخطوات في إدارة المرض مليئة بالتحديات، وقد تؤدي الأخطاء إلى اعتلال المرضى ووفياتهم. تشمل التحديات الحاجة إلى التشخيص الدقيق للمرض وتحديد مراحل المرض لتوجيه القرارات السريرية، والمراقبة المستمرة لتطور المرض بعد العلاج، والتي يمكن أن تكون معقدة بسبب الإشارات الصادرة من الأنسجة العصبية المجاورة، والأهمية المتزايدة لتحديد أنماط النمط الجيني. هذه الأنماط الجينية لها تأثير كبير على سلوك الورم والنتائج السريرية. في نهاية المطاف، تنشأ تحديات إدارة أورام المخ من عوامل مختلفة، بما في ذلك تعقيدات المخ، ومحدودية إمكانية الوصول إلى إجراءات التصوير الدقيق وإجراءات الخزعة الدقيقة، وعدم التجانس المتأصل في بيولوجيا الورم، ومعدلات التقدم المتغيرة، والتباين الفردي في قابلية العلاج، والافتقار النسبي للمؤشرات الحيوية الموثوقة التي تنبئ بالتشخيص. كما أن حساسية الأنسجة العصبية لطرق العلاج القياسية، بما في ذلك الجراحة والإشعاع والعلاج الكيميائي، تزيد من تعقيدات الرعاية.
ثالثا: دور الذكاء الاصطناعي في الأشعة التشخيصية
يعتمد علم الأمراض العصبية تقليديًا على تحاليل الأنسجة وافحوصات السريرية، ويستند تشخيص أورام المخ بشكل أساسي على نتائج التصوير العصبي، باستخدام تقنيات مثل التصوير المقطعي المحوسب مع الصبغة (CT) أو التصوير بالرنين المغناطيسي (MRI).نشهد الآن ثورة في علم الأمراض العصبية بسبب تطور تقنيات الذكاء الاصطناعي مثل التعلم الآلي (ML) والتعلم العميق (DL). تعمل هذه التقنيات على تعزيز دقة التشخيص، وتحسين سير العمل، وتمكين استراتيجيات العلاج الشخصي. تتفوق خوارزميات الذكاء الاصطناعي في تحليل الصور المرضية النسيجية، وغالباً ما تكشف عن تغيرات مورفولوجية دقيقة تغفلها الطرق التقليدية.
- التعلم الآلي
يدمج التعلم الآلي (ML)، الذي يندرج تحت مظلة الذكاء الاصطناعي، الخوارزميات والنماذج الإحصائية لوضع تنبؤات حول نقاط البيانات الجديدة. في التعلّم الآلي، تتعلم الحواسيب تلقائيًا من تراكم البيانات وتتحسن مع الخبرة.
- التعلم العميق (DL)
هو فئة فرعية من التعلم الآلي الذي يعالج البيانات الخام غير المهيكلة باستخدام شبكات عصبية اصطناعية متعددة الطبقات. وهو حاليًا أساس معظم أدوات الذكاء الاصطناعي المستخدمة في تفسير الصور. حيث يمكنه استخراج السمات المميزة وتحليلها.
أحد أكثر تطبيقات الذكاء الاصطناعي شيوعًا هو تحليل التصوير التشخيصي.غالبًا ما تبدأ مراحل تحليل الصور بتحويل البيانات المرئية الأولية إلى صيغة مفهومة لنماذج التعلم العميق المختلفة. ويعد هذا التحويل أمرًا بالغ الأهمية، سواء كان النموذج المستخدم هو الشبكة العصبية التلافيفية (CNN) أو محول الرؤية (ViT) أو أي بنية متقدمة أخرى. ويكمن الجوهر الأساسي لهذه النماذج في قدرتها على تفسير المحتوى المرئي للصور من خلال الكشف عن الآفات والتنبؤ بدرجاتها.يمكن للذكاء الاصطناعي تحسين تشخيص الآفات الصغيرة باستخدام بيانات التصوير بالرنين المغناطيسي والتصوير المقطعي المحوسب والتصوير المقطعي المحوسب والتصوير المقطعي بالإصدار البوزيتروني.
- تطبيقات الذكاء الاصطناعي في تقييم الورم الدبقي
نظرًا لأن الأورام الدبقية غالبًا ما يتم تشخيصها عندما تكون كبيرة الحجم وتظهر عليها الأعراض، فإن اكتشاف الآفات الشبيهة بالورم الدبقي في التصوير بالرنين المغناطيسي قد يبدو أمرًا تافهًا نسبيًا بالنسبة لأخصائي الأشعة العصبية المتمرس. وعلى العكس من ذلك، فإن التشخيص المبكر للنقائل الدماغية الصغيرة لدى مرضى الأورام أثناء المتابعة يمثل تحدياً، لأن الحساسية في التصوير بالرنين المغناطيسي متغيرة، ويمكن أن تؤثر العديد من تفاصيل الحصول على التصوير بالرنين المغناطيسي على الأداء.
ومع ذلك، نظرًا لأن بروتوكولات الجراحة الإشعاعية التجسيمية وغيرها من القرارات العلاجية تعتمد على عدد وموقع النقائل حتى الصغيرة منها، فإن التشخيص المبكر يمثل مصدر قلق حقيقي لأطباء الأشعة العصبية، نظرًا لتأثيره الكبير على تشخيص المريض. لهذا السبب، تركز معظم أدوات الكشف بمساعدة الحاسوب (CAD) المتوفرة في مجال طب الأورام العصبية بشكل أساسي على الكشف الآلي عن النقائل الدماغية. ويعد الضبط المناسب لأدوات الكشف بمساعدة الحاسوب (CAD) أمرًا ضروريًا لضمان دقة التشخيص، وتقليل خطر التشخيص الزائد، والإفراط في العلاج، والقلق غير المعقول لدى المرضى. بشكل عام، إذا كانت حساسية بداية قراءة الجهازمنخفضة للغاية، يمكن أن يتأثر النموذج بمعدل إيجابي كاذب مرتفع، على سبيل المثال، بما في ذلك الأنسجة الوعائية بدلاً من النقائل الصغيرة؛ من ناحية أخرى، عندما تكون العتبة عالية، يمكن أن يفشل النموذج في اكتشاف الآفات الصغيرة (على وجه الخصوص، <3 مم).
- تطبيقات الذكاء الاصطناعي في تقييم الورم غير الدبقي
الأورام المخية غير الدبقية هي مجموعة متنوعة من الأورام المخية التي يمكن أن تنشأ من أنواع ومواقع مختلفة من الخلايا داخل الجهاز العصبي المركزي. وهي تشمل الأورام النقيلية والأورام السحائية وأورام الغدة النخامية وأورام الغدة النخامية والأورام البطانية والأورام الأرومية النخاعية والأورام الأرومية الوعائية وغيرها. تتميز هذه الأورام بخصائص نسيجية ومظاهر سريرية وتشخيصية وخيارات علاجية مختلفة. لذلك، تُعد الطرق الدقيقة والموثوقة لتصنيف أورام المخ ضرورية لتحسين الشبكات العصبية القائمة على المحولات في تصوير أورام المخ المحولات، وهي بنية رائدة أحدثت في البداية ثورة في معالجة اللغة الطبيعية، كما رأينا في نماذج مثل ChatGPT، وقد توسعت إلى ما هو أبعد من غرضها الأصلي. فقد مهّد نجاحها الملحوظ في فهم اللغة البشرية وتوليدها الطريق أمام تطبيقها في الطب، وتحديداً تصوير الأورام العصبية ، مما يوفر تطورات واعدة في تشخيص أورام المخ وتصنيفها وعلاجها.
وعلى سبيل المثال، يمكن لنماذج التعلّم العميق المطبقة على علم الأمراض الرقمي أن تُميّز بفعالية بين درجات الأورام واكتشاف الأمراض النادرة، مما يؤدي إلى تشخيصات مبكرة وأكثر دقة. ويُعد التقدم في التصوير العصبي أداة أخرى مفيدة للذكاء الاصطناعي، حيث يدعم التحليل المحسّن للتصوير بالرنين المغناطيسي والتصوير المقطعي المحوسب الكشف المبكر عن الأمراض العصبية التنكسية. من خلال تحديد المؤشرات الحيوية وأنماط تطور المرض، يساعد الذكاء الاصطناعي في التدخلات العلاجية في الوقت المناسب، مما قد يؤدي إلى إبطاء تطور المرض. في علم الأمراض الجزيئية، تساعد قدرة الذكاء الاصطناعي على تحليل البيانات الجينومية المعقدة في الكشف عن الأساس الجيني والجزيئي للحالات المرضية العصبية، مما يسهل خطط العلاج الشخصية.
رابعا: دور الذكاء الاصطناعي في العلاج
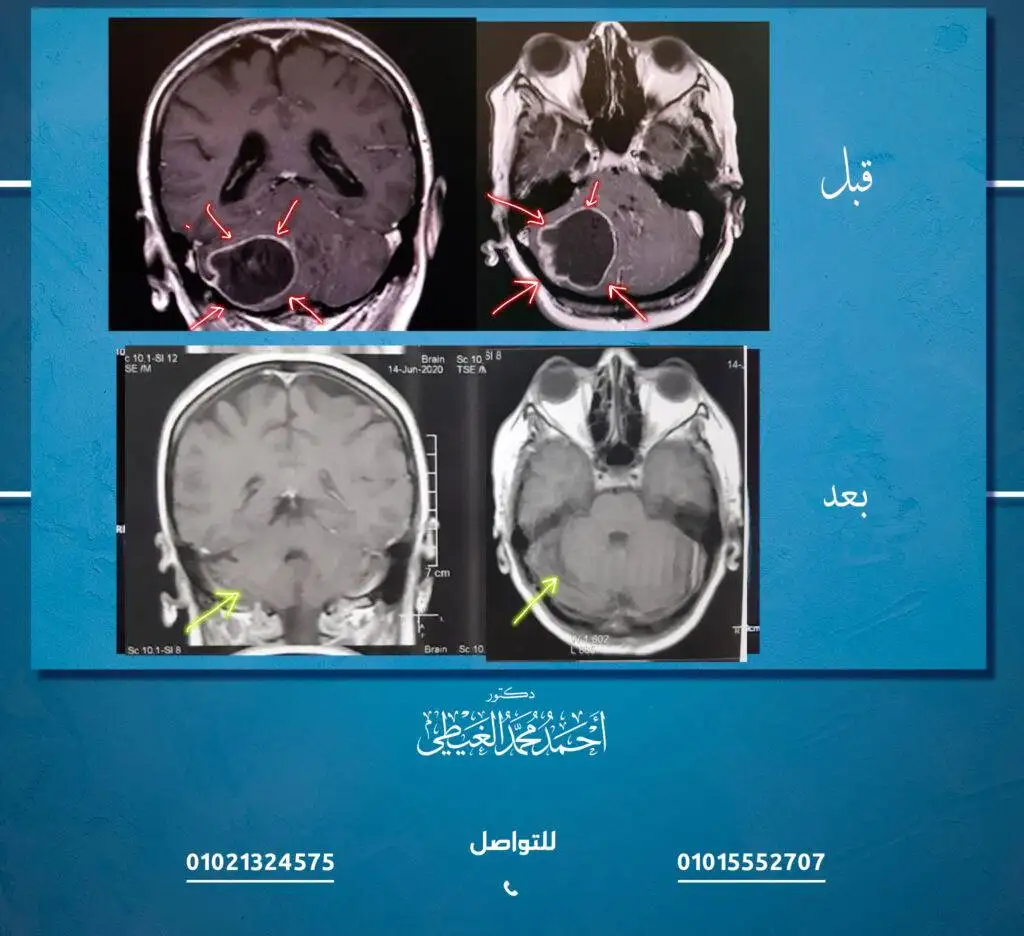
طوّر الباحثون نموذجًا يعمل بالذكاء الاصطناعي يمكنه – في 10 ثوانٍ – تحديد ما إذا كان أي جزء من ورم سرطاني في الدماغ يمكن إزالته متبقيًا أثناء الجراحة، وذلك.وقد تفوقت هذه التقنية، التي أطلق عليها اسم FastGlioma، على الطرق التقليدية لتحديد ما تبقى من الورم بهامش واسع، وفقًا لفريق البحث الذي قادته جامعة ميشيغان وجامعة كاليفورنيا سان فرانسيسكو. إن FastGlioma هو نظام تشخيصي قائم على الذكاء الاصطناعي لديه القدرة على تغيير مجال جراحة الأعصاب من خلال تحسين الإدارة الشاملة للمرضى الذين يعانون من الأورام الدبقية المنتشرة على الفور“.
تعمل هذه التقنية بشكل أسرع وأكثر دقة من طرق الرعاية القياسية الحالية للكشف عن الورم ويمكن تعميمها على تشخيص أورام المخ لدى الأطفال والبالغين الآخرين. ويمكن أن تكون بمثابة نموذج أساسي لتوجيه جراحة أورام الدماغ. فعندما يقوم جراح الأعصاب باستئصال ورم يهدد حياة المريض من دماغه، نادرًا ما يكون قادرًا على استئصال الكتلة بأكملهاويُعرف ما يتبقى بالورم المتبقي.وعادةً ما يتم تفويت الورم أثناء العملية لأن الجراحين غير قادرين على التفريق بين الدماغ السليم والورم المتبقي في التجويف الذي تمت إزالة الكتلة منه.
قد يتشابه الورم المتبقي مع الدماغ السليم، وهو ما يمثل تحدياً كبيراً في الجراحة. تستخدم فرق جراحة الأعصاب طرقاً مختلفة لتحديد موقع هذا الورم المتبقي أثناء العملية. قد يحصلون على تصوير بالرنين المغناطيسي، وهو ما يتطلب آلات أثناء الجراحة لا تتوفر في كل مكان. ويمكن أن يستخدم الجراح أيضاً عامل تصوير فلوري لتحديد نسيج الورم، وهو ما لا ينطبق على جميع أنواع الأورام؛ تمنع هذه القيود استخدامها على نطاق واسع.وهذا يعني أنه يمكننا الكشف عن ارتشاح الورم في ثوانٍ وبدقة عالية للغاية، مما قد يُعلم الجراحين إذا كانت هناك حاجة إلى مزيد من الاستئصال أثناء العملية.
ففي أحد الدراسات الدولية للتقنيات التي تعتمد على الذكاء الاصطناعي، قامت فرق جراحة الأعصاب بتحليل عينات جديدة غير معالجة مأخوذة من 220 مريضًا خضعوا لعمليات جراحية لورم دبقي منتشر منخفض أو عالي الدرجة. قام FastGlioma باكتشاف وحساب كمية الورم المتبقية بمتوسط دقة 92% تقريباً.
في مقارنة بين العمليات الجراحية الموجهة بتنبؤات FastGlioma أو الطرق الموجهة بالصور والفلورسنت، لم تُخطئ تقنية الذكاء الاصطناعي في اكتشاف الورم المتبقي عالي الخطورة بنسبة 3.8% فقط من الوقت – مقارنةً بنسبة 25% تقريباً من معدل الخطأ في الطرق التقليدية.
يقول الدكتور شون هيرفي-جامبر، قائد فريق عمل هذة الدراسة وأستاذ جراحة الأعصاب في جامعة كاليفورنيا سان فرانسيسكو: ”هذا النموذج هو خروج مبتكر عن التقنيات الجراحية الحالية من خلال تحديد تسلل الورم بسرعة بدقة مجهرية باستخدام الذكاء الاصطناعي، مما يقلل بشكل كبير من خطر فقدان الورم المتبقي في المنطقة التي يتم فيها استئصال الورم الدبقي“. ”إن تطوير FastGlioma يمكن أن يقلل من الاعتماد على التصوير الإشعاعي أو تعزيز التباين أو الملصقات الفلورية لتحقيق أقصى قدر من إزالة الورم.“
كيفية عمل جهاز FastGlioma
لتقييم ما تبقى من ورم في الدماغ، يجمع FastGlioma بين التصوير البصري المجهري المجهري ونوع من الذكاء الاصطناعي يسمى نماذج الأساس. وهي عبارة عن نماذج ذكاء اصطناعي، مثل GPT-4 وDALL-E 3، تم تدريبها على مجموعات بيانات ضخمة ومتنوعة يمكن تكييفها مع مجموعة واسعة من المهام. بعد التدريب على نطاق واسع، يمكن لنماذج الأساس تصنيف الصور، والعمل كروبوتات دردشة، والرد على رسائل البريد الإلكتروني، وتوليد الصور من الأوصاف النصية.
لبناء FastGlioma، قام الباحثون بالتدريب المسبق لنموذج الأساس البصري باستخدام أكثر من 11,000 عينة جراحية و4 ملايين مجال رؤية مجهري فريد. تم تصوير عينات الورم من خلال علم أنسجة رامان المحفز، وهي طريقة للتصوير البصري السريع وعالي الدقة تم تطويرها في جامعة ميريلاند. وقد استُخدمت التقنية نفسها لتدريب نظام DeepGlioma، وهو نظام فحص تشخيصي قائم على الذكاء الاصطناعي يكتشف الطفرات الجينية لورم الدماغ في أقل من 90 ثانية. يمكن لنظام FastGlioma اكتشاف أنسجة الورم المتبقية دون الاعتماد على إجراءات علم الأنسجة التي تستغرق وقتًا طويلاً ومجموعات البيانات الكبيرة والمصنفة في مجال الذكاء الاصطناعي الطبي، وهي نادرة“.
تستغرق الصور كاملة الدقة حوالي 100 ثانية للحصول على صور كاملة الدقة باستخدام علم أنسجة رامان المحفّز؛ بينما تستغرق الصورة ذات الدقة المنخفضة ”الوضع السريع“ 10 ثوانٍ فقط. وجد الباحثون أن نموذج الدقة الكاملة حقق دقة تصل إلى 92%، بينما حقق الوضع السريع دقة أقل قليلاً بنسبة 90% تقريباً.
وهذا يعني أنه يمكننا الكشف عن ارتشاح الورم في ثوانٍ بدقة عالية للغاية، وهو ما يمكن أن يُعلم الجراحين إذا كانت هناك حاجة إلى مزيد من الاستئصال أثناء العملية.
خامسا: دور الذكاء الاصطناعي في التكهن المرضي
قد تتنبأ تطبيقات الذكاء الاصطناعي أيضًا بالاستجابة للعلاج المناعي، بالإضافة إلى تحسين الجرعة وبروتوكول العلاج في رعاية أورام الدماغ، يلعب الذكاء الاصطناعي دورًا محوريًا في تطوير القدرات التنبؤية. ويجري تسخير تقنيات التعلم الآلي وتقنيات التعلم الآلي والذكاء الاصطناعي بشكل متزايد للتنبؤ بنظام التشغيل والتشخيص، والاستفادة من الميزات المستخرجة من بيانات التصوير قبل العلاج.
تُظهر الدراسات الجديرة بالملاحظة، بما في ذلك الفحوصات الإشعاعية من التصوير بالرنين المغناطيسي T1 وFLAIR لمرضى الورم الأرومي الدبقي، وفحوصات T1 وT2 وFLAIR من المرضى الذين لم يخضعوا للعلاج، نتائج واعدة في التنبؤ بفترة البقاء على قيد الحياة بشكل عام والبقاء على قيد الحياة دون تقدم المرض. تتفوق نماذج الذكاء الاصطناعي على المتغيرات السريرية الروتينية وتظهر تفوقًا عند دمجها مع الأعراض السريرية لدى مرضى الورم الأرومي الدبقي. ومن اللافت للنظر، تكشف النماذج القائمة على التصوير بالرنين المغناطيسي المرجّح والصور الإشعاعية من الوذمة حول الورم عن علاقتها بتكهن فترة البقاء على قيد الحياة وموقع الانتكاسة والصفة الجينية له، خاصة في مرضى الورم الدبقي، ومرضى الورم الأرومي الدبقي. يتم إنشاء النماذج القائمة على DL لتحديد الأورام والتنبؤ بموقع معاودة الورم الورمي وأحيانًا قبل أن يتمكن أخصائيو الأشعة من اكتشافه. تسلط هذه النماذج، باستخدام طرق تصوير مختلفة، الضوء على القدرات التنبؤية الاستثنائية للذكاء الاصطناعي.
سادسا: التحديات التي تواجه الذكاء الاصطناعي في علاج أورام المخ
- محدودية البيانات
يعتمد نجاح نماذج الذكاء الاصطناعي بشكل كبير على توفر مجموعات بيانات مفصلة عالية الجودة. في مجال علم الأمراض العصبية، من الصعب الحصول على بيانات مرجعية وقياسية بسبب الاختلافات في كيفية تحضير العينات وصباغتها وتفسيرها من قبل اختصاصيين مختلفين. يعد إنشاء قاعدة بيانات كبيرة ومتنوعة ومفصلة جيدًا أمرًا ضروريًا لتطوير نماذج ذكاء اصطناعي قوية. ولتحسين إمكانية تعميم هذه النماذج، من المهم وضع بروتوكولات موحدة لجمع البيانات والتشخيصات التوضيحية وتعزيز التعاون بين المؤسسات لإنشاء قواعد بيانات مركزية.
يتمثل أحد التحديات الكبيرة التي تواجه الاعتماد السريري لنماذج الذكاء الاصطناعي في طبيعتها ”الصندوق الأسود“. ويحتاج أخصائيو علم الأمراض والأطباء السريريون إلى فهم المنطق الكامن وراء النتائج التي يولدها الذكاء الاصطناعي للثقة في هذه الأدوات ودمجها بفعالية في الفحوصات السريرية. من الضروري تطوير نماذج الذكاء الاصطناعي القابلة للتفسير وتقديم نتائج واضحة ومفهومة. يمكن لتقنيات مثل آليات الانتباه وخرائط البروز وأطر الذكاء الاصطناعي القابلة للتفسير أن توضح كيفية اتخاذ نماذج الذكاء الاصطناعي للقرارات. يمكن أن يضمن إشراك الأطباء السريريين في عمليات التطوير والتحقق من الصحة أن أدوات الذكاء الاصطناعي تلبي الاحتياجات السريرية وتحظى بقبول أسهل.
- الأخلاقيات والخصوصية
إن نشر الذكاء الاصطناعي في الأوساط الطبية يثير مخاوف تنظيمية وأخلاقية مهمة. إن حماية خصوصية البيانات وأمنها أمر بالغ الأهمية، لا سيما مع معلومات المرضى الحساسة. يجب أن تتكيف الأطر التنظيمية لمواجهة التحديات المحددة للذكاء الاصطناعي، بما في ذلك التحقق من صحة أنظمة الذكاء الاصطناعي والموافقة عليها ومراقبتها المستمرة. يجب النظر بعناية في القضايا الأخلاقية، مثل التحيزات المحتملة في خوارزميات الذكاء الاصطناعي وتأثيراتها على رعاية المرضى. من الضروري الإبلاغ بشفافية عن أداء نماذج الذكاء الاصطناعي، بما في ذلك حدودها وتحيزاتها. بالإضافة إلى ذلك، يجب تحديث إجراءات الموافقة الواعية لمراعاة استخدام الذكاء الاصطناعي في التشخيص ووضع العلاج.
الخاتمة
يُظهر الذكاء الاصطناعي نتائج واعدة في التشخيص والتشخيص والتكهن وتخطيط العلاج من خلال الكشف عن أورام الدماغ وتصنيفها بفعالية من الصور الطبية. من خلال التحليلات الإشعاعية والباثومية والجينومية، يساهم الذكاء الاصطناعي في التوصيف الدقيق للورم. في العلاج، يلعب الذكاء الاصطناعي دورًا حاسمًا في التخطيط والتحسين والتنبؤ بالاستجابة، ودعم التوصيات المتخصصة والمراقبة في الوقت المناسب. يتماشى تكامل الأساليب القائمة على الذكاء الاصطناعي مع الطب الوقائي والرعاية المتمحورة حول المريض. ومع ذلك، فإن اعتماد الذكاء الاصطناعي في التعامل مع أورام الدماغ يتطلب دراسة متأنية للآثار الأخلاقية والقانونية والاجتماعية، ومعالجة المخاوف المتعلقة بخصوصية البيانات والفوارق في الرعاية الصحية.
تشمل الاتجاهات المستقبلية سد الثغرات البحثية، واستكشاف نماذج للتعلم الآلى، وتكامل البيانات متعددة الوسائط، وتطوير المراقبة في الوقت الحقيقي. تعد نماذج الذكاء الاصطناعي المدربة على مجموعات بيانات متنوعة واعدة للتنبؤ بالاستجابات العلاجية وتحسين نتائج المرضى. يعد التطوير والتحسين المستمر أمرًا ضروريًا للكشف عن الإمكانات والتحديات الكاملة في الإدارة السريرية لأورام الدماغ، مما يجعل الذكاء الاصطناعي أداة قيمة في البحث والممارسة.